Produtos

Avastin 400Mg
Laboratório: Roche
R$ 10.900,00
VALOR SEM IMPOSTO
Descrição
Avastin®
Bevacizumabe
Antineoplásico
Identificação de Avastin
Nome do produto: Avastin®
Nome genérico: bevacizumabe
Forma farmacêutica, via de administração e apresentações
Solução injetável concentrada para infusão intravenosa.
Caixa com 1 frasco-ampola de dose única de 100 mg (4 mL) ou 400 mg (16 mL).
USO ADULTO
Composição de Avastin
Avastin® injetável 100 mg Frasco-ampola de 4 mL contendo:
Princípio ativo:
Bevacizumabe (anticorpo monoclonal antiVEGF humanizado)..........................100 mg (25 mg/mL).
Excipientes: α, α-trealose diidratada, diidrogeno fosfato de sódio monoidratado (fosfato de sódio, monobásico, monoidratado), fosfato dissódico anidro (fosfato de sódio, dibásico), polissorbato 20 e água para injetável.
Avastin® injetável 400 mg Frasco-ampola de 16 mL contendo:
Princípio ativo:
bevacizumabe (anticorpo monoclonal antiVEGF humanizado)..........................400 mg (25 mg/mL)
Excipientes: α, α-trealose diidratada, diidrogeno fosfato de sódio monoidratado (fosfato de sódio, monobásico, monoidratado), fosfato dissódico anidro (fosfato de sódio, dibásico), polissorbato 20 e água para injetável.
Informações ao Paciente de Avastin
Solicitamos a gentileza de ler cuidadosamente as informações abaixo. Caso não esteja seguro a respeito de determinado item, favor informar ao seu médico.
1. AÇÃO DO MEDICAMENTO Avastin® é o nome comercial para bevacizumabe, um anticorpo monoclonal humanizado recombinante que reduz a vascularização de tumores, inibindo assim o crescimento tumoral.
O medicamento começa a agir logo após sua administração.
2. INDICAÇÕES DO MEDICAMENTO Câncer colorretal metastático (CCRm) Avastin®, em combinação com quimioterapia à base de fluoropirimidina, é indicado para o tratamento de pacientes com carcinoma metastático do cólon ou do reto.
Câncer de mama metastático ou localmente recorrente (CMM) Avastin®, em combinação com quimioterapia à base de taxanos, é indicado para o tratamento de pacientes com câncer de mama localmente recorrente ou metastático que não tenham recebido quimioterapia.
Câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente Avastin®, em combinação com quimioterapia à base de platina, é indicado para o tratamento de primeira linha de pacientes com câncer de pulmão de não pequenas células, não escamoso, irressecável, localmente avançado, metastático ou recorrente.
Câncer de células renais metastático e/ou avançado (mRCC) Avastin®, em combinação com alfainterferona 2a, é indicado para o tratamento de primeira linha de pacientes com câncer de células renais avançado e/ou metastático.
3. RISCOS DO MEDICAMENTO Contraindicações Avastin® é contraindicado a pacientes com hipersensibilidade ou alergia conhecida a qualquer componente do produto ou a outros produtos que contenham substâncias parecidas com bevacizumabe.
Advertências/precauções Existem várias condições que requerem cuidados na administração deste medicamento. Seu médico saberá identificar essas situações e adotará as medidas adequadas. Essas situações incluem a possibilidade de ocorrer perfurações intestinais, aumento da pressão arterial, problemas de cicatrização de feridas e de cortes cirúrgicos, derrame cerebral e infarto agudo do miocárdio (principalmente em indivíduos com idade acima de 65 anos), hemorragias, entre outras. Solicite informações ao seu médico se desejar saber mais detalhes a respeito dessas condições.
Principais interações medicamentosas Não houve diferenças clinicamente relevantes nem estatisticamente significativas na depuração de bevacizumabe em pacientes que receberam Avastin® em monoterapia, em comparação com pacientes que receberam Avastin® em combinação com alfainterferona 2a ou quimioterapias (IFL, 5-FU/LV, carboplatina/paclitaxel, capecitabina, doxorrubicina ou cisplatina/gencitabina).
Resultados de estudos de interação medicamentosa demonstraram que o efeito de bevacizumabe não alterou de maneira significativa a farmacocinética do irinotecano e do seu metabólito ativo SN38 (estudo AVF3135g), da capecitabina e seus metabólitos (estudo NP18587), da oxaliplatina, determinado pela mensuração da platina livre e total (estudo NP18587), alfainterferona 2a (estudo BO17705) e cisplatina (estudo BO17704).
Por causa da elevada variabilidade interpaciente e o tamanho limitado da amostra, os resultados do estudo BO17704 não permitem uma conclusão sobre o impacto de bevacizumabe sobre a farmacocinética da gencitabina.
Idosos A idade acima de 65 anos está associada a risco aumentado de problemas vasculares arteriais, que incluem derrame cerebral e infarto do miocárdio, durante o tratamento com Avastin®.
Crianças A eficácia e a segurança de Avastin® em pacientes pediátricos não estão estabelecidas.
Pacientes com insuficiência hepática ou renal A eficácia e a segurança de Avastin® em pacientes com insuficiência hepática ou renal não foram estudadas.
Gravidez e amamentação Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Em mulheres com potencial para engravidar, recomenda-se a adoção de medidas contraceptivas adequadas durante todo o período de tratamento e pelo menos seis meses depois da última dose de Avastin®.
Não se sabe se o bevacizumabe é excretado no leite humano. Assim, as mulheres devem ser orientadas a interromper o aleitamento materno durante o tratamento e a não amamentar durante pelo menos seis meses depois da última dose de Avastin®.
Este medicamento não deve ser utilizado por mulheres durante a amamentação. Efeitos sobre a capacidade de dirigir e operar máquinas Não foram realizados estudos sobre a capacidade de dirigir e operar máquinas. No entanto, não existe nenhuma evidência de que o tratamento com Avastin® resulte em aumento dos eventos adversos que possam prejudicar a capacidade mental ou levar ao comprometimento da capacidade de dirigir ou operar máquinas.
A eficácia e a segurança de Avastin® em pacientes pediátricos não foram estudadas.
Informe ao médico ou cirurgião-dentista o aparecimento de reações indesejáveis.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
4. MODO DE USO Avastin® em seu frasco-ampola original é um líquido incolor ou de coloração levemente castanhoclara.
Este medicamento é de uso hospitalar e deve ser preparado por um profissional da saúde, de maneira asséptica, misturado com soro fisiológico para infusão intravenosa antes de ser administrado.
Este medicamento deve apenas ser aplicado por profissionais treinados e habilitados para administrá-lo. Seu médico conhece os detalhes da administração e poderá lhe fornecer todas as informações desejadas.
Câncer colorretal metastático (CCRm) A dose recomendada de Avastin® em terapia de primeira linha é de 5 mg/kg de peso, administrada uma vez a cada 14 dias, por infusão intravenosa, ou 7,5 mg/kg de peso, administrada uma vez a cada 21 dias, por infusão intravenosa. A dose recomendada em terapia de segunda linha é 10 mg/kg de peso, administrada uma vez a cada 14 dias, ou 15 mg/kg de peso, administrada uma vez a cada 21 dias.
Câncer de mama metastático (CMM) A dose recomendada de Avastin® é de 10 mg/kg de peso, administrada a cada duas semanas, ou 15 mg/kg de peso, administrada a cada três semanas, por infusão intravenosa.
Câncer de pulmão de não pequenas células avançado, metastático ou recorrente Avastin® é administrado em associação com quimioterapia à base de platina, em até seis ciclos de tratamento, seguidos de Avastin® em monoterapia até progressão da doença.
A dose recomendada de Avastin®, quando usado em associação com quimioterapia à base de cisplatina, é de 7,5 mg/kg de peso corporal, administrada uma vez a cada três semanas, por infusão intravenosa.
A dose recomendada de Avastin®, quando usado em associação com quimioterapia à base de carboplatina, é de 15 mg/kg de peso corporal, administrada uma vez a cada três semanas, por infusão intravenosa.
Câncer de células renais metastático e/ou avançado (mRCC) A dose recomendada de Avastin® é de 10 mg/kg de peso, administrada a cada duas semanas, por infusão intravenosa.
O tratamento com Avastin® em monoterapia deve ser mantido até a progressão da doença de base.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar observe o aspecto do medicamento.
5. REAÇÕES ADVERSAS Assim como os medicamentos antitumorais de modo geral, Avastin® pode causar reações indesejáveis.
As reações indesejáveis mais frequentemente observadas em todos os estudos clínicos nos pacientes que receberam Avastin®, com ou sem quimioterapia, foram cansaço, diarreia, dor abdominal e aumento da pressão arterial. Outras reações descritas incluem náuseas e presença de proteínas na urina. As reações mais graves relatadas foram perfurações gastrintestinais, hemorragias e trombose arterial.
Atenção: este é um medicamento novo, e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Nesse caso, informe ao seu médico.
6. CONDUTA EM CASO DE SUPERDOSE É muito pouco provável que você receba dose excessiva de Avastin®. Se isso acontecer, os principais sintomas corresponderão às reações indesejáveis descritas para o medicamento, que serão reconhecidos por seu médico que também saberá como tratá-los.
7. CUIDADOS DE CONSERVAÇÃO Antes de aberto, Avastin® deve ser mantido em refrigerador, em temperaturas de 2 a 8 ºC. O frasco deve ser mantido dentro da embalagem externa original, para proteger da luz, até o momento da utilização.
Avastin® não contém nenhum conservante antimicrobiano; portanto, depois de aberto, deve-se tomar cuidado para garantir a esterilidade da solução preparada. Depois de misturado com soro fisiológico para administração, o produto deve ser utilizado imediatamente. Se não utilizado imediatamente, o tempo e as condições de armazenamento são de responsabilidade do usuário, não devendo ultrapassar 24 horas e temperaturas de 2 a 8 ºC, a menos que a diluição tenha sido feita em condições assépticas controladas e validadas.
NÃO CONGELAR. NÃO AGITAR.
Estabilidade A data de fabricação e o prazo de validade de Avastin® estão impressos na embalagem externa do produto. Não use nenhum medicamento fora do prazo de validade. Pode ser prejudicial à saúde.
Todo medicamento deve ser mantido fora do alcance das crianças.
Informações Técnicas Aos Profissionais de Saúde de Avastin
1. CARACTERÍSTICAS FARMACOLÓGICAS Descrição Avastin® é o nome comercial de bevacizumabe, um anticorpo monoclonal humanizado recombinante, produzido por tecnologia de DNA recombinante em um sistema de expressão de célula de mamífero de ovário de hamster chinês, em um meio nutriente que contém o antibiótico gentamicina e é purificado por um processo que inclui inativação viral específica e etapas de remoção. Gentamicina é detectável no produto final em ≤ 0,35 ppm. O bevacizumabe é constituído de 214 aminoácidos e tem um peso molecular de aproximadamente 149.000 dáltons.
Farmacodinâmica Mecanismo de ação: Avastin® é um anticorpo monoclonal humanizado recombinante que se liga e neutraliza seletivamente a atividade biológica do fator de crescimento do endotélio vascular humano (VEGF). O bevacizumabe contém regiões estruturais humanas, com regiões ligantes de antígenos de um anticorpo murino humanizado, que se liga ao VEGF. Avastin® inibe a ligação de VEGF aos seus receptores, Flt-1 e KDR, na superfície das células endoteliais. A neutralização da atividade biológica do VEGF reduz a vascularização de tumores, inibindo, assim, o crescimento tumoral. A administração de bevacizumabe ou de seu anticorpo murino original a modelos de xenoenxerto de câncer em camundongos resultou em atividade antitumoral extensa em cânceres humanos, incluindo câncer de cólon, mama, pâncreas e próstata. A progressão da doença metastática foi inibida, e a permeabilidade microvascular foi reduzida.
Dados de segurança pré-clínicos Desenvolvimento epifisário: em estudos com até 26 semanas de duração em macacos cynomolgus, Avastin® esteve associado à displasia epifisária, caracterizada principalmente por espessamento da cartilagem da placa de crescimento, formação de placa óssea subcondral e inibição de invasão vascular da placa de crescimento. Esse efeito ocorreu em doses ≥ 0,8 vez a dose terapêutica humana e níveis de exposição discretamente abaixo da exposição clínica humana esperada, com base em concentrações séricas médias. Deve-se notar, no entanto, que a displasia epifisária ocorreu apenas em animais em crescimento ativo, com placas de crescimento abertas. Como Avastin® será mais provavelmente administrado a pacientes adultos com placas de crescimento fechadas, não se espera que a displasia epifisária ocorra nessa população.
Cicatrização de feridas: os efeitos de bevacizumabe sobre cicatrização de feridas circulares foram estudados em coelhos. A reepitelização de feridas foi retardada em coelhos após cinco doses de bevacizumabe de 2 a 50 mg/kg, durante duas semanas. Foi observada tendência à relação com a dose. A magnitude do efeito sobre a cicatrização de feridas foi semelhante à observada com a administração de corticosteroides. Ao cessar o tratamento com 2 ou 10 mg/kg de bevacizumabe, as feridas se fecharam completamente. A menor dose, 2 mg/kg, foi aproximadamente equivalente à dose terapêutica proposta. Um modelo mais sensível, de cicatrização de ferida linear, também foi estudado em coelhos. A administração de três doses de bevacizumabe, variando de 0,5 a 2 mg/kg, reduziu, de forma dose dependente, a tensão da ferida, o que foi compatível com o retardo da cicatrização da ferida. A menor dose, 0,5 mg/kg, foi cinco vezes menor que a dose terapêutica proposta.
Como foram observados efeitos sobre cicatrização de feridas em coelhos, com doses abaixo da dose terapêutica proposta, a capacidade de bevacizumabe exercer impacto adverso sobre cicatrização de feridas no homem deve ser considerada.
Em macacos cynomolgus, os efeitos de bevacizumabe sobre a cicatrização de incisão linear foram altamente variáveis, e uma relação entre a dose e a resposta não ficou evidente.
Função renal: em macacos cynomolgus normais, bevacizumabe não apresentou nenhum efeito mensurável sobre a função renal, quando administrado uma ou duas vezes por semana, durante até 26 semanas, e não se acumulou no rim de coelhos, depois de duas doses de até 100 mg/kg (aproximadamente 80 vezes maior que a dose terapêutica proposta).
Estudos de pesquisa de toxicidade em coelhos que usaram os modelos de disfunção renal mostraram que bevacizumabe não exacerbou a lesão glomerular renal induzida por albumina de soro bovino ou a lesão tubular renal induzida por cisplatina.
Albumina: em macacos cynomolgus machos, bevacizumabe administrado em doses de 10 mg/kg, duas vezes por semana, ou 50 mg/kg, uma vez por semana, durante 26 semanas, foi associado com redução estatisticamente significativa da albumina, da razão entre albumina e globulina e aumento da globulina.
Esses efeitos foram reversíveis com a interrupção da exposição. Como os parâmetros permaneceram dentro do intervalo de referência normal de valores para esses desfechos, essas alterações não foram consideradas clinicamente significativas.
Hipertensão: em doses de até 50 mg/kg, duas vezes por semana, em macacos cynomolgus, bevacizumabe não apresentou nenhum efeito sobre a pressão arterial.
Hemostasia: estudos de toxicologia não clínica, durante até 26 semanas, em macacos cynomolgus não encontraram alterações hematológicas ou nos parâmetros de coagulação, incluindo número de plaquetas, tempo de protrombina e tromboplastina parcial ativada. Um modelo de hemostasia em coelhos, usado para pesquisar o efeito de bevacizumabe sobre a formação de trombos, não demonstrou alteração na velocidade de formação de trombos ou nenhum outro parâmetro hematológico em comparação ao tratamento com veículo de bevacizumabe.
Mutagenicidade/carcinogenicidade: não foram realizados estudos para avaliar o potencial carcinogênico e mutagênico de Avastin®.
Toxicidade reprodutiva: não foram realizados estudos específicos em animais para avaliar o efeito de Avastin® sobre a fertilidade. Não foi observado nenhum efeito adverso nos órgãos reprodutivos masculinos em estudos de toxicidade com doses repetidas em macacos cynomolgus.
A inibição da função ovariana foi caracterizada por reduções no peso ovariano e/ou uterino e no número de corpos lúteos, redução na proliferação endometrial e inibição da maturação folicular em macacos cynomolgus tratados com Avastin® durante 13 ou 26 semanas. As doses associadas com esse efeito foram ≥ 4 vezes a dose terapêutica humana ou ≥ 2 vezes acima da exposição humana esperada com base nas concentrações séricas médias em macacos fêmeas.
Em coelhos, a administração de 50 mg/kg de bevacizumabe resultou em redução significativa do peso ovariano e do número de corpos lúteos. Os resultados em macacos e coelhos foram reversíveis com a interrupção do tratamento. É provável que a inibição da angiogênese após a administração de bevacizumabe resulte em um efeito adverso sobre a fertilidade feminina.
Teratogenicidade: foi demonstrado que Avastin® é embriotóxico e teratogênico quando administrado a coelhos. Os efeitos observados incluíram reduções de peso materno e fetal, número aumentado de reabsorções fetais e incidência aumentada de alterações macroscópicas e esqueléticas fetais específicas. As evoluções fetais adversas foram observadas em todas as doses testadas, de 10 a 100 mg/kg.
Farmacocinética A farmacocinética de bevacizumabe foi caracterizada em pacientes com diversos tipos de tumores sólidos. As doses testadas foram de 0,1 - 10 mg/kg, a cada semana, em fase I; de 3 - 20 mg/kg, a cada duas ou três semanas, em fase II; 5 mg/kg, a cada duas semanas, ou 15 mg/kg, a cada três semanas, em fase III. Em todos os estudos clínicos, o bevacizumabe foi administrado por infusão intravenosa (IV). Como observado com outros anticorpos, as propriedades farmacocinéticas de bevacizumabe são bem representadas por um modelo bicompartimental. De modo geral, com base nos estudos clínicos, a distribuição de bevacizumabe foi caracterizada por uma baixa depuração, volume limitado do compartimento central (Vc) e meia-vida de eliminação prolongada.
Isso permite que os níveis séricos terapêuticos desejados de bevacizumabe sejam mantidos com uma variação do esquema de administração (tal como uma administração a cada duas ou três semanas).
Na análise farmacocinética populacional de bevacizumabe, não foi constatada diferença significativa na farmacocinética de bevacizumabe em relação à idade (nenhuma correlação entre a depuração de bevacizumabe e a idade do paciente [a mediana de idade foi de 59 anos, com IC 95, 37 a 76 anos]).
Um grande impacto clínico da doença e hipoalbuminemia são geralmente indicativos da gravidade da doença. A depuração de bevacizumabe foi, aproximadamente, 30% maior em pacientes com níveis baixos de albumina sérica e 7% maior em pacientes com um maior impacto clínico da doença, em comparação com pacientes com valores medianos de albumina e massa tumoral.
Distribuição: o valor do volume do compartimento central (Vc) foi de 2,73 litros e 3,28 litros para mulheres e homens, respectivamente, sendo essa a faixa que tem sido descrita para IgGs e outros anticorpos monoclonais. O valor do volume periférico (Vp) foi de 1,69 litro e 2,35 litros para mulheres e homens, respectivamente, quando bevacizumabe é coadministrado com agentes antineoplásicos. Após a correção para o peso corporal, os homens apresentaram Vc maior (+20%) que as mulheres.
Metabolismo: a avaliação do metabolismo de bevacizumabe em coelhos após dose única IV de I125-bevacizumabe indicou que seu perfil metabólico foi semelhante ao esperado para uma molécula de IgG original que não se liga ao VEGF. O metabolismo e a eliminação de bevacizumabe são similares ao da IgG endógena, ou seja, ocorrem principalmente por meio do catabolismo proteolítico em todo o corpo, inclusive nas células endoteliais, e não dependem fundamentalmente da eliminação por meio dos rins e fígado. A ligação da IgG ao receptor FcRn a protege do metabolismo celular e resulta na meia-vida terminal longa.
Eliminação: a farmacocinética de bevacizumabe é linear em doses de 1,5 até 10 mg/kg/semana.
O valor para a depuração é, na média, igual a 0,188 L/dia para mulheres e 0,220 L/dia para homens. Após a correção para o peso corporal, os homens apresentavam depuração de bevacizumabe maior (+ 17%) que as mulheres. Conforme o modelo bicompartimental, a meia-vida de eliminação é de 18 dias para um típico paciente feminino e de 20 dias para um típico paciente masculino.
Farmacocinética em populações especiais As farmacocinéticas populacionais foram analisadas para avaliar os efeitos das características demográficas. Os resultados mostraram não haver diferenças significativas na farmacocinética de bevacizumabe em relação à idade.
Crianças e adolescentes: a farmacocinética de bevacizumabe foi estudada em um número limitado de pacientes pediátricos. Os dados farmacocinéticos resultantes sugerem que o volume de distribuição e a depuração de bevacizumabe foram comparáveis aos de adultos com tumores sólidos.
Pacientes com disfunção renal: não foram realizados estudos para investigar a farmacocinética de bevacizumabe em pacientes com disfunção renal, já que os rins não são os principais órgãos do metabolismo e excreção de bevacizumabe.
Pacientes com disfunção hepática: não foram realizados estudos para investigar a farmacocinética de bevacizumabe em pacientes com disfunção hepática, já que o fígado não é o principal órgão do metabolismo e excreção de bevacizumabe.
2. RESULTADOS DE EFICÁCIA Câncer colorretal metastático (CCRm) A segurança e a eficácia da dose recomendada de Avastin® (5 mg/kg de peso, a cada duas semanas) em carcinoma metastático do cólon ou reto foram estudadas em três estudos clínicos randomizados, com controle ativo, que avaliaram a combinação de Avastin® com quimioterapia à base de fluoropirimidina como primeira linha de câncer colorretal metastático.1, 2, 3, 4, 5 Avastin® foi combinado com dois esquemas quimioterápicos:
• Estudo AVF2107g: um esquema semanal de irinotecano/5-fluorouracil e leucovorin em bolus (esquema IFL), durante um total de quatro semanas, dentro de cada ciclo de seis semanas.1
• Estudo AVF0780g: em combinação com 5-fluorouracil/leucovorin (5-FU/LV) em bolus, durante um total de seis semanas, dentro de cada ciclo de oito semanas (esquema Roswell Park).2
• Estudo AVF2192g: em combinação com 5-fluorouracil/leucovorin (5-FU/LV) em bolus, durante um total de seis semanas, dentro de cada ciclo de oito semanas (esquema Roswell Park), em pacientes que não eram candidatos ideais para tratamento de primeira linha com irinotecano.3
Dois estudos clínicos adicionais foram conduzidos em terapia de primeira linha (NO16966) e segunda linha (E3200), para tratamento de câncer colorretal metastático com Avastin®, administrado nos regimes a seguir descritos, em combinação com FOLFOX-4 (5-FU/LV/oxaliplatina) e XELOX (capecitabina/oxaliplatina):
• NO16966: Avastin®, 7,5 mg/kg de peso, a cada três semanas, em combinação com capecitabina oral e oxaliplatina intravenosa (XELOX) ou Avastin®, 5 mg/kg, a cada duas semanas, em combinação com leucovorin e 5-FU em bolus, seguido de 5-FU infusional com oxaliplatina intravenosa (FOLFOX-4).4
• E3200: Avastin®, 10 mg/kg de peso, a cada duas semanas, em combinação com leucovorin e 5-FU em bolus, seguido de 5-FU infusional com oxaliplatina intravenosa (FOLFOX-4).5
AVF2107g: Esse foi um estudo fase III, randomizado, duplo-cego, com controle ativo, que avaliou Avastin® em combinação com IFL como tratamento de primeira linha para carcinoma metastático do cólon ou reto.1 Oitocentos e treze pacientes foram randomizados para receber IFL + placebo (Braço 1) ou IFL + Avastin® (5 mg/kg, a cada duas semanas, Braço 2). Um terceiro grupo de 110 pacientes recebeu 5-FU em bolus/LV + Avastin® (Braço 3). A inclusão no Braço 3 foi interrompida, conforme predeterminado, depois que foi estabelecida e considerada aceitável a segurança de Avastin® combinado ao esquema IFL.
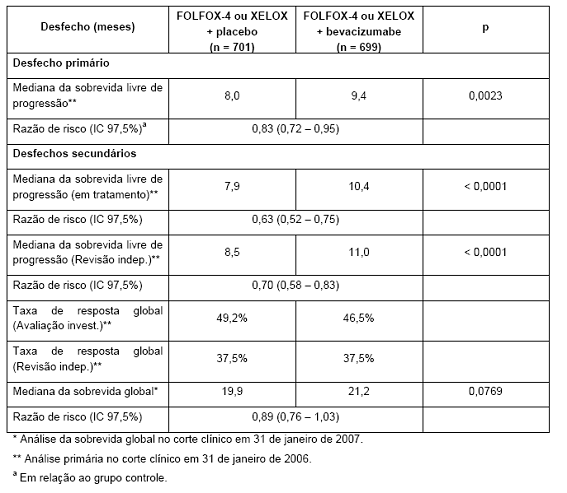
O desfecho primário de eficácia do estudo foi a sobrevida global. A adição de Avastin® ao IFL resultou em aumento estatisticamente significativo da sobrevida global, sobrevida livre de progressão (SLP) e taxa de resposta global (Tabela 1). O benefício clínico de Avastin®, medido pela sobrevida, foi observado em todos os subgrupos predeterminados de pacientes, incluindo os definidos por idade, sexo, estado de desempenho (performance status), localização do tumor primário, número de órgãos envolvidos e duração da doença metastática.
Antes da descontinuação do Braço 3 (5-FU/LV + Avastin®), entre os 110 pacientes randomizados, a mediana de sobrevida global foi de 18,3 meses, e a de sobrevida livre de progressão foi de 8,8 meses.
AVF2192g: Esse foi um estudo clínico fase II, randomizado, duplo-cego, com controle ativo, que estudou os efeitos de Avastin® em combinação com 5-FU/leucovorin como tratamento de primeira linha para câncer colorretal metastático em pacientes que não eram candidatos ideais para tratamento de primeira linha com irinotecano. Cento e cinco pacientes foram randomizados para 5-FU/LV + placebo, e 104 foram randomizados para 5-FU/LV + Avastin® (5 mg/kg, a cada duas semanas). Todos os tratamentos foram mantidos até a progressão da doença.
A adição de Avastin®, 5 mg/kg, a cada duas semanas, ao 5-FU/LV resultou em maiores taxas de resposta objetiva, sobrevida livre de progressão significativamente mais prolongada e tendência a sobrevida mais prolongada em comparação com a quimioterapia 5-FU/LV apenas.
NO16966: Esse foi um estudo clínico fase III, randomizado, duplo-cego (para bevacizumabe), que investigou Avastin®, 7,5 mg/kg, em combinação com capecitabina oral e oxaliplatina IV (XELOX), administrado em um esquema de três semanas, ou Avastin®, 5 mg/kg, em combinação com leucovorin e 5-FU em bolus, seguido de 5-FU infusional com oxaliplatina IV (FOLFOX-4), administrados em um esquema de duas semanas. Esse estudo continha duas partes: uma parte inicial de dois braços (parte I), na qual os pacientes foram divididos em dois braços de tratamento diferentes (XELOX e FOLFOX-4) e uma subsequente 2x2 fatorial (parte II), na qual os pacientes foram divididos em quatro braços de tratamento (XELOX + placebo, FOLFOX-4 + placebo, XELOX + Avastin®, FOLFOX-4 + Avastin®). Na parte II, a inclusão ao tratamento, em relação a Avastin® , foi duplo-cego.
Aproximadamente 350 pacientes foram randomizados para cada um dos quatro braços na parte II desse estudo.
Tabela 2. Regimes de tratamento: estudo NO16966 (CCRm)
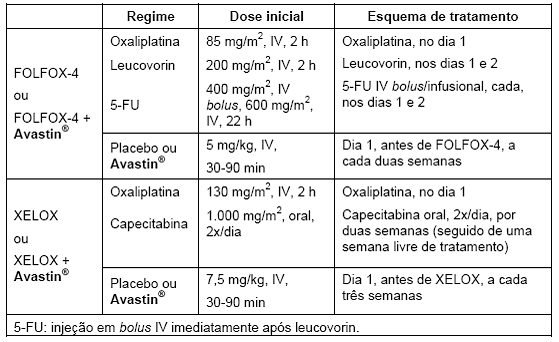
O desfecho primário de eficácia desse estudo foi a duração da sobrevida livre de progressão.
Existiam dois desfechos primários: demonstrar que XELOX não era inferior a FOLFOX-4 e que Avastin® em combinação com FOLFOX-4 ou XELOX era superior à quimioterapia somente. Os dois objetivos coprimários foram alcançados.
a) A não inferioridade dos braços que continham XELOX em relação aos braços que continham FOLFOX-4, em uma comparação global, foi demonstrada em termos de sobrevida livre de progressão e sobrevida global na população elegível por protocolo.
b) A superioridade dos braços que continham Avastin® versus quimioterapia sem adição de Avastin® foi demonstrada em uma comparação global, em termos de sobrevida livre de progressão, na população com intenção de tratamento (vide Tabela 3).
A análise secundária de SLP, baseada no comitê de revisão independente (CRI) e nas respostas baseadas no subgrupo em tratamento, confirmou, de maneira significativa, o benefício clínico superior aos pacientes tratados com Avastin® (análise de subgrupo na Tabela 3), compatível com o benefício estatisticamente significativo observado na análise combinada.
Tabela 3. Resultados-chave de eficácia para a análise de superioridade (população intenção de tratamento, estudo NO16966)
ECOG E3200: Esse foi um estudo clínico fase III, aberto, randomizado, com controle ativo, que investigou Avastin®, 10 mg/kg, em combinação com leucovorin e 5-FU em bolus, seguido de 5-FU infusional com oxaliplatina intravenosa (FOLFOX-4), administrado em um esquema de duas semanas, em pacientes previamente tratados (segunda linha) com câncer colorretal avançado. Nos braços de quimioterapia, o regime FOLFOX-4 utilizou as mesmas doses e modo de administração do esquema adotado no estudo NO16966, como mostra a Tabela 2.
O desfecho primário de eficácia desse estudo foi a sobrevida global, definida como o tempo entre a randomização e óbito por qualquer causa. Oitocentos e vinte e nove pacientes foram selecionados aleatoriamente (292 FOLFOX-4, 293 Avastin® + FOLFOX-4 e 244 monoterapia com Avastin®). A adição de Avastin® a FOLFOX-4 resultou em prolongamento estatisticamente significativo da sobrevida global. Melhoras estatisticamente significativas em sobrevida livre de progressão e taxa de resposta objetiva também foram observadas (vide Tabela 4).
Tabela 4. Resultado de eficácia: estudo E3200
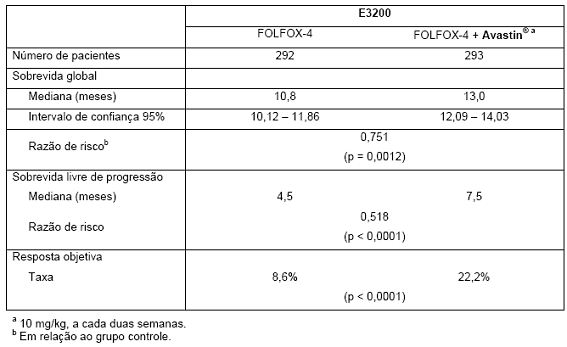
Não foi observada diferença significativa na duração de sobrevida global entre pacientes que receberam Avastin® em monoterapia comparados aos pacientes tratados com FOLFOX-4.
A sobrevida livre de progressão e a taxa de resposta objetiva foram inferiores no braço de Avastin® em monoterapia em comparação com o braço com FOLFOX-4.
Câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente A segurança e a eficácia de Avastin® como tratamento de primeira linha de pacientes com câncer de pulmão de não pequenas células, excluindo histologia predominantemente escamosa, foram estudadas em associação com quimioterapia à base de platina nos estudos E4599 e BO17704.
E45996: O estudo E4599 foi multicêntrico, aberto, randomizado, controlado para avaliação de Avastin® como tratamento de primeira linha de pacientes com câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente, excluindo histologia predominantemente escamosa.
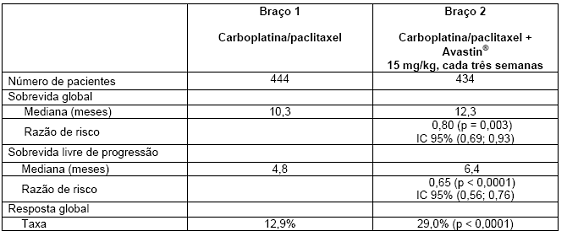
Os pacientes foram randomizados para receber quimioterapia à base de platina (paclitaxel 200 mg/m2 e carboplatina ASC = 6,0), ambos administrados por infusão IV, no dia 1 de cada ciclo de três semanas, até um total de seis ciclos, ou para o braço com carboplatina e paclitaxel em associação com Avastin®, na dose de 15 mg/kg, administrado por infusão IV no dia 1 de cada ciclo de três semanas. Após a conclusão dos seis ciclos de quimioterapia com carboplatina/paclitaxel ou após descontinuação prematura da quimioterapia, os pacientes no braço de Avastin® + carboplatina/paclitaxel continuaram a receber Avastin® em monoterapia a cada três semanas até progressão da doença. Foram randomizados para os dois braços de tratamento 878 pacientes.
Durante o estudo, dos pacientes que receberam medicação de ensaio, 32,2% (136/422) receberam de 7 a 12 administrações de Avastin® e 21,1% (89/422) receberam 13 ou mais administrações de Avastin®.
O desfecho primário foi sobrevida global. Os resultados são apresentados na Tabela 5.
Tabela 5. Resultados de eficácia: estudo E4599
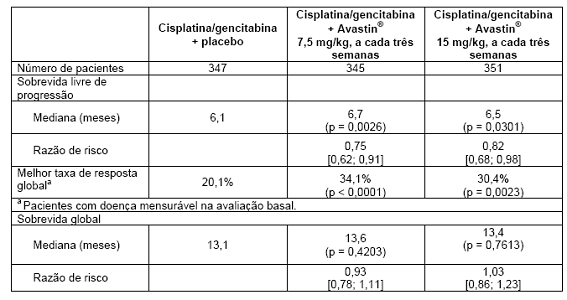
BO17704 7,8:
O estudo BO17704 foi de fase III, randomizado, duplo-cego, com Avastin® em associação à cisplatina e gencitabina versus placebo, cisplatina e gencitabina, em pacientes com câncer de pulmão de não pequenas células não escamoso, localmente avançado, metastático ou recorrente, não previamente tratados com quimioterapia. O desfecho primário foi a sobrevida livre de progressão (SLP), e os secundários incluíram a duração da resposta, sobrevida global e segurança.
Os pacientes foram randomizados para o braço de quimioterapia à base de platina, cisplatina 80 mg/m2, administrada por infusão IV, no dia 1, e 1.250 mg/m2 de gencitabina, administrada por infusão IV, nos dias 1 e 8 de cada ciclo, a cada três semanas até um total de seis ciclos (CG), com placebo ou para o braço de CG com Avastin®, na dose de 7,5 mg/kg ou 15 mg/kg, administrada por infusão IV, no dia 1 de cada ciclo, a cada três semanas. Nos braços que continham Avastin®, os pacientes receberam Avastin® em monoterapia a cada três semanas até progressão da doença ou toxicidade inaceitável.
Os resultados do estudo mostraram que 94% (277/296) dos doentes elegíveis continuaram a receber bevacizumabe em monoterapia no ciclo 7. Uma elevada proporção de pacientes (aproximadamente 62%) continuou a receber uma variedade de terapias antineoplásicas não especificadas no protocolo que podem ter impactado a análise da sobrevida global.
Os resultados de eficácia são apresentados na Tabela 6.
Tabela 6. Resultados de eficácia: estudo BO17704
Câncer de mama metastático (CMM) 9,10
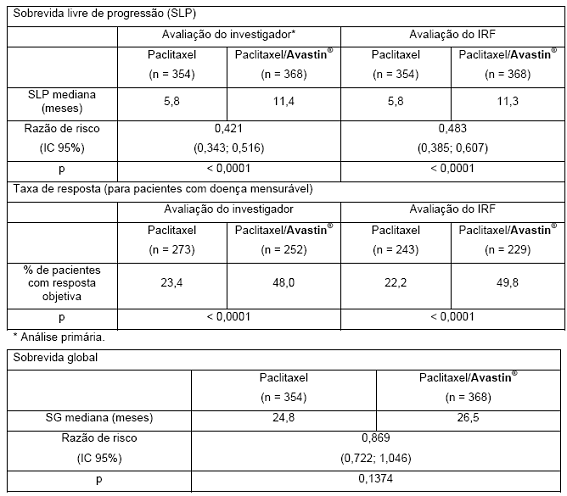
ECOG E2100: E2100 foi um estudo clínico multicêntrico, aberto, randomizado, com controle-ativo, para avaliação de Avastin® em combinação com paclitaxel para câncer de mama metastático ou localmente recorrente em pacientes que não haviam recebido quimioterapia prévia para doença metastática ou localmente recorrente.
Terapia hormonal prévia para o tratamento de doença metastática foi permitida. Terapia adjuvante prévia com taxano foi permitida apenas se completada pelo menos 12 meses antes da inclusão no estudo.
Pacientes foram randomizados para receber paclitaxel em monoterapia (90 mg/m2, IV, em uma hora, uma vez por semana, por três ou quatro semanas) ou em combinação com Avastin® (10 mg/kg, infusão IV, a cada duas semanas). Os pacientes deveriam permanecer no estudo até a progressão da doença. Nos casos em que os pacientes descontinuaram a quimioterapia prematuramente, o tratamento com Avastin® em monoterapia foi mantido até a progressão da doença. O desfecho primário foi sobrevida livre de progressão (SLP), avaliada pelos investigadores. Adicionalmente, uma revisão independente dos desfechos primários também foi realizada. Dos 722 pacientes do estudo, a maioria tinha doença HER2 negativa (90%). Um pequeno número de pacientes tinha status HER2 desconhecido (8%) ou positivo (2%). Pacientes que estavam com HER2 positivo haviam sido previamente tratados com trastuzumabe ou foram considerados inadequados para trastuzumabe. A maioria, 65% dos pacientes, tinha recebido quimioterapia adjuvante, incluindo 19% que receberam terapia prévia com taxanos e 49% que receberam terapia prévia com antraciclinas. As características dos pacientes eram similares entre os braços de estudo.
Os resultados desse estudo estão apresentados na tabela 7.
Tabela 7. Resultados de eficácia do estudo E2100: pacientes elegíveis
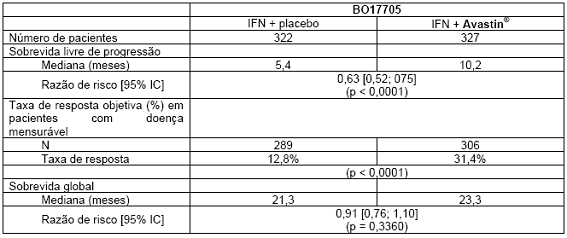
Câncer de células renais metastático e/ou avançado (mRCC)11,12:
O estudo BO17705 foi um estudo de fase III, multicêntrico, randomizado, duplo-cego, conduzido para avaliar a eficácia e a segurança de Avastin® em combinação com alfainterferona 2ª (Roferon®) versus alfainterferona 2a em monoterapia como tratamento de primeira linha em mRCC. Os 649 pacientes randomizados (641 tratados) tinham RCC de células claras metastático, desempenho Karnofsky ≥ 70%, ausência de metástases no sistema nervoso central e função orgânica adequada. O tratamento fornecido incluiu alfainterferona 2a (9 MUI, três vezes por semana) mais Avastin® (10 mg/kg, a cada duas semanas) ou placebo, administrados até a progressão da doença. Os pacientes foram estratificados de acordo com o país e escore de Motzer, e os braços de tratamento mostraram ser equilibrados para os fatores de prognóstico.
O desfecho primário foi a sobrevida global, com desfechos secundários para o estudo, incluindo sobrevida livre de progressão (SLP). A adição de Avastin® à alfainterferona 2a aumentou significativamente a SLP e a taxa de resposta objetiva do tumor. Esses resultados foram confirmados através de uma revisão radiológica independente. No entanto, o aumento no desfecho primário de sobrevida global em dois meses não foi significativo (HR = 0,91). Uma alta proporção de pacientes (aproximadamente 63% IFN/placebo, 55% Avastin®/IFN) recebeu uma série de terapias anticâncer pós-protocolo não especificadas, incluindo agentes antineoplásicos, que pode ter impactado na análise da sobrevida global.
Tabela 8. Resultados de eficácia: estudo BO17705
Um modelo de regressão de Cox multivariada exploratória utilizando seleção retrógada indicou que os seguintes fatores prognósticos basais estavam fortemente associados com a sobrevida, independente do tratamento: sexo, contagem de glóbulos brancos, plaquetas, perda de peso nos seis meses antecedentes à entrada no estudo, número de sítios metastáticos, soma do maior diâmetro das lesões-alvo, escore de Motzer. O ajuste para esses fatores basais resultou em uma razão de risco de tratamento de 0,78 (95% IC [0,63; 0,96], p = 0,0219), indicando uma redução de 22% no risco de morte para os pacientes do braço Avastin® + alfainterferona 2a, em comparação com o braço alfainterferona 2a.
Noventa e sete (97) pacientes do braço alfainterferona 2a e 131 pacientes do braço de Avastin® reduziram a dose de alfainterferona 2a de 9 MUI para 6 ou 3 MUI, três vezes por semana, como pré-especificado no protocolo. A redução da dose da alfainterferona 2a pareceu não afetar a eficácia do uso combinado de Avastin® e alfainterferona 2a, com base nas taxas de SLP livres de eventos ao longo do tempo, como mostrado por uma análise de subgrupo. Os 131 pacientes do braço Avastin® + alfainterferona 2a que reduziram e mantiveram a dose de alfainterferona 2a em 6 ou 3 MUI durante o estudo exibiram em 6, 12 e 18 meses, taxas de SLP livres de eventos de 73, 52 e 21%, respectivamente, em comparação com 61, 43 e 17% na população total de pacientes tratados com Avastin® + alfainterferona 2a.
AVF2938: Foi um estudo clínico de fase II, randomizado, duplo-cego, para avaliar Avastin®, 10 mg/kg, em um esquema a cada duas semanas, com a mesma dose de Avastin® em combinação com 150 mg/dia de erlotinibe, em pacientes com RCC de células claras metastático. Foram randomizados 104 pacientes para o tratamento nesse estudo, 53 para 10 mg/kg de Avastin®, a cada duas semanas, mais placebo, e 51 para 10 mg/kg de Avastin®, a cada duas semanas, mais erlotinibe, 150 mg/dia. A análise do desfecho primário não mostrou diferença entre o braço de Avastin® + placebo e o de Avastin® + erlotinibe (mediana de SLP de 8,5 versus 9,9 meses). Sete pacientes em cada braço apresentaram uma resposta objetiva.
Referências Bibliográficas de Avastin
1. Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. NEJM 2004;350(23):2335-42.
2. Kabbinavar FF, Hurwitz HI, Fehrenbacher L, et al. Phase II, randomized trial comparing bevacizumab plus fluorouracil (FU)/leucovorin(LV) with FV/LV alone in patients with metastatic colorectal cancer. JCO 2003;21:60-5.
3. Kabbinavar FF, Schulz J, McCleod M, et al. Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer: results of a randomized phase II trial. JCO 2005;23(16):3697-3705.
4. Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as firstline therapy in metastatic colorectal cancer: a randomized phase III study. JCO 2008;26(12):2013-19.
5. Giantonio BJ, Catalano PJ, Meropol NJ et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from Eastern Cooperative Oncology Group Study E3200. JCO 2007;25(12):1539-44.
6. Lyons B. & Raimes D. A.
Clinical Study Report E4599. A randomised phase II/III trial of paclitaxel plus carboplatin with or without bevacizumab in patients with advanced nonsquamous NSCLC.
7. Bourson A.
Clinical Study Report – BO17704: A randomized, double-blind multicenter 2-stage phase III study of bevacizumab in combination with cisplatin and gemcitabine versus placebo, cisplatin and gemcitabine in patients with advanced or recurrent non-squamous non-small cell lung cancer, who have not received prior chemotherapy. Research Report 1023798.
8. Clinical Study Report Addendum – BO17704
Report n° 1028245, September 2008.
9. Zheng B., Klencke, B., Mackey H. & Hambleton J.
Clinical Study Report E2100: A Randomized Phase lll Trial of Paclitaxel plus Bevacizumab (rhuMAb VEGF) as First- Line Therapy for Locally Recurrent or Metastatic Breast Cancer. May 2006.
10. Updated Clinical Study Report E2100.
11. Hainsworth JD, et al. Treatment of metastatic renal cell carcinoma with a combination of bevacizumab and erlotinib. JCO 2005; 23:7889-7896.
12. Board RE, et al. Anti-angiogenic therapy in the treatment of advanced renal cell cancer. Cancer Treatment Reviews
2007, 33: 1-8.
3. INDICAÇÕES Câncer colorretal metastático (CCRm) Avastin®, em combinação com quimioterapia à base de fluoropirimidina, é indicado para o tratamento de pacientes com carcinoma metastático do cólon ou do reto.
Câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente Avastin®, em combinação com quimioterapia à base de platina, é indicado para o tratamento de primeira linha de pacientes com câncer de pulmão de não pequenas células, não escamoso, irresecável, localmente avançado, metastático ou recorrente.
Câncer de mama metastático ou localmente recorrente (CMM) Avastin®, em combinação com quimioterapia à base de taxanos, é indicado para o tratamento de pacientes com câncer de mama localmente recorrente ou metastático que não tenham recebido quimioterapia.
Câncer de células renais metastático e/ou avançado (mRCC) Avastin®, em combinação com alfainterferona 2a, é indicado para o tratamento de primeira linha de pacientes com câncer de células renais avançado e/ou metastático.
4. CONTRAINDICAÇÕES Avastin® é contraindicado a pacientes com hipersensibilidade conhecida a qualquer componente do produto, a produtos de células de ovário de hamster chinês ou a outros anticorpos recombinantes humanos ou humanizados.
5. MODO DE USAR E CUIDADOS DE CONSERVAÇÃO DEPOIS DE ABERTO Condições de conservação Avastin® não contém nenhum conservante antimicrobiano; portanto, deve-se tomar cuidado para garantir a esterilidade da solução preparada.
A estabilidade química e física durante o uso foi demonstrada durante 48 horas em temperaturas de 2 a 30 ºC em solução de cloreto de sódio 0,9%. Do ponto de vista microbiológico, o produto deve ser usado imediatamente. Se não usado imediatamente, o tempo e as condições de armazenamento em uso são de responsabilidade do usuário e normalmente não deve ultrapassar 24 horas, em temperatura de 2 a 8 ºC, a menos que a diluição tenha sido feita em condições assépticas controladas e validadas.
NÃO CONGELAR. NÃO AGITAR. Preparação e administração da solução de infusão Avastin® deve ser preparado por profissional da saúde, empregando técnica asséptica.
Retire a quantidade necessária de bevacizumabe e dilua em um volume necessário para administração com solução de cloreto de sódio a 0,9% (soro fisiológico). A faixa de concentração da solução de bevacizumabe final deve ser mantida entre 1,4 e 16,5 mg/mL.
Despreze qualquer quantidade deixada no frasco-ampola, pois este medicamento não contém conservantes. Medicamentos para infusão parenteral devem ser inspecionados visualmente quanto à presença de partículas e à descoloração antes da administração.
Não foi observada nenhuma incompatibilidade entre Avastin® e bolsas de cloreto de polivinila ou poliolefina. Foi observado perfil de degradação dependente de concentração de Avastin® quando diluído com soluções de dextrose (5%).
Infusões de Avastin® não devem ser administradas ou misturadas com soluções de dextrose ou glicose.
Produtos parenterais devem ser inspecionados visualmente, para verificar a presença de partículas e alterações de coloração do líquido, antes da administração.
Descarte Como o produto não contém conservantes, todo o restante não usado do frasco de Avastin® deve ser descartado.
Descarte de medicamentos não utilizados e/ou com prazo de validade vencido
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser desprezados no esgoto, e o descarte em lixo doméstico deve ser evitado. Descarte conforme orientações disponíveis no sistema de coleta local.
Manuseio Precauções devem ser tomadas no manuseio de Avastin®.
Não administrar em injeção intravenosa direta ou em bolus. A dose inicial de Avastin® deve ser administrada em 90 minutos, por infusão intravenosa. Se a primeira infusão for bem tolerada, a segunda infusão pode ser administrada durante 60 minutos.
Se a infusão em 60 minutos for bem tolerada, todas as infusões subsequentes podem ser administradas em 30 minutos.
A redução da dose de Avastin® devido à presença de eventos adversos não é recomendada. Se indicado, Avastin® deve ser suspenso ou temporariamente interrompido (vide item Advertências).
Atenção A velocidade de infusão recomendada não deve ser excedida.
Vias de administração Avastin® é de uso exclusivamente injetável e deve ser administrado por via parenteral (intravenosa).
Prazo de validade Este medicamento possui prazo de validade a partir da data de fabricação (vide embalagem externa do produto). Não use este medicamento após a data de validade indicada na embalagem.
Pode ser prejudicial à saúde.
6. POSOLOGIA Dosagem padrão Câncer colorretal metastático (CCRm) A dose recomendada de Avastin® em terapia de primeira linha é de 5 mg/kg de peso, administrada uma vez a cada 14 dias, por infusão intravenosa, ou 7,5 mg/kg de peso, administrada uma vez a cada 21 dias, por infusão intravenosa. A dose recomendada em terapia de segunda linha é 10 mg/kg de peso, administrada uma vez a cada 14 dias, ou 15 mg/kg de peso, administrada uma vez a cada 21 dias.
Câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente Avastin® é administrado em combinação com quimioterapia à base de platina em até seis ciclos de tratamento, seguidos de Avastin® em monoterapia até progressão da doença.
A dose recomendada de Avastin®, quando usado em associação com quimioterapia à base de cisplatina, é de 7,5 mg/kg de peso, administrada uma vez a cada três semanas, por infusão intravenosa.
A dose recomendada de Avastin®, quando usado em associação com quimioterapia à base de carboplatina, é de 15 mg/kg de peso, administrada uma vez a cada três semanas, por infusão intravenosa.
Câncer de mama metastático ou localmente recorrente (CMM) A dose recomendada de Avastin® é de 10 mg/kg de peso, administrada a cada duas semanas, ou 15 mg/kg de peso, administrada a cada três semanas, por infusão intravenosa.
Câncer de células renais metastático e/ou avançado (mRCC) A dose recomendada de Avastin® é de 10 mg/kg de peso, administrada a cada duas semanas, por infusão intravenosa.
Recomenda-se que o tratamento com Avastin® seja mantido continuamente até a progressão da doença de base.
Instruções de dosagens especiais Crianças e adolescentes: a segurança e a eficácia de Avastin® em crianças e adolescentes não foram estabelecidas.
Insuficiência renal e hepática: a segurança e a eficácia de Avastin® não foram estudadas em pacientes com insuficiência renal ou hepática. Idosos: não há recomendações especiais de doses para idosos.
7. ADVERTÊNCIAS Perfurações gastrintestinais Pacientes podem estar sob risco aumentado para desenvolvimento de perfuração gastrintestinal, quando tratados com Avastin® (vide item Reações adversas a medicamentos). Avastin® deve ser suspenso permanentemente em pacientes que desenvolverem perfuração gastrintestinal.
Fístula (vide item Reações adversas a medicamentos) Os pacientes podem ter um risco aumentado para o desenvolvimento de fístula quando tratados com Avastin®.
O tratamento com Avastin® deve ser permanentemente descontinuado em pacientes com fístula traqueoesofágica ou qualquer fístula grau 4. A informação disponível ainda é limitada quanto ao uso contínuo de Avastin® em pacientes com outros tipos de fístulas. Em casos de fístula interna não gastrintestinal, a descontinuação de Avastin® deve ser considerada.
Hemorragia (vide item Reações adversas a medicamentos) Pacientes tratados com Avastin® apresentam risco aumentado de hemorragia, especialmente hemorragias associadas ao tumor. Avastin® deve ser suspenso definitivamente em pacientes que apresentarem sangramento graus 3 ou 4 durante o tratamento com Avastin®.
Baseando-se em diagnósticos por imagens, sinais ou sintomas, pacientes com metástases no SNC não tratadas foram rotineiramente excluídos dos estudos clínicos com Avastin®. Portanto, o risco de hemorragia no SNC em tais pacientes não foi avaliado prospectivamente em estudos clínicos randomizados. Os pacientes devem ser monitorados quanto a sinais e sintomas de sangramento no SNC, e o tratamento com Avastin® deve ser interrompido em caso de sangramento intracraniano.
Não existe nenhuma informação sobre o perfil de segurança de Avastin® em pacientes com diátese hemorrágica congênita, coagulopatia adquirida ou que receberam dose plena de anticoagulantes para tratamento de tromboembolismo antes do início do tratamento com
Avastin®, visto pacientes com tais condições terem sido excluídos dos estudos clínicos. Portanto, recomenda-se cautela antes de iniciar o tratamento com Avastin® nesses pacientes. No entanto, pacientes que desenvolveram trombose venosa enquanto tratados com Avastin® não parecem apresentar incidência aumentada de sangramento grau 3 ou maior quando tratados com dose plena de varfarina e Avastin® concomitantemente.
Hemorragia pulmonar/hemoptise Pacientes com câncer de pulmão de não pequenas células tratados com Avastin® podem ter risco de apresentar hemorragia pulmonar/hemoptise grave e, em alguns casos, fatal. Pacientes com hemorragia pulmonar/hemoptise recente (> ½ colher de chá de sangue) não devem ser tratados com Avastin®.
Hipertensão Foi observada incidência aumentada de hipertensão em pacientes tratados com Avastin®. Dados de segurança clínica sugerem que a incidência de hipertensão é provavelmente dose dependente. Hipertensão preexistente deve ser adequadamente controlada antes de iniciar o tratamento com Avastin®. Não existem informações sobre o efeito de Avastin® em pacientes com hipertensão não controlada quando do início do tratamento com Avastin®. O monitoramento da pressão arterial é recomendável durante o tratamento com Avastin® (vide item Reações adversas a medicamentos).
Na maioria dos casos, a hipertensão foi adequadamente controlada com terapia antihipertensiva padrão para a situação individual do paciente afetado. Avastin® deve ser permanentemente interrompido se a hipertensão não puder ser adequadamente controlada com medicamentos anti-hipertensivos ou se o paciente desenvolver crise hipertensiva ou encefalopatia hipertensiva (vide item Reações adversas a medicamentos).
Síndrome da Leucoencefalopatia Posterior Reversível (SLPR) Houve raros relatos de pacientes tratados com Avastin® que tenham desenvolvido sinais e sintomas que são consistentes com a Síndrome da Leucoencefalopatia Posterior Reversível (SLPR), um raro distúrbio neurológico, o qual pode apresentar os seguintes sinais e sintomas, dentre outros: convulsões, cefaleia, alteração do nível de consciência, distúrbio visual ou cegueira cortical, com ou sem hipertensão associada. Um diagnóstico de SLPR requer confirmação por imagem cerebral. Em pacientes que desenvolvem SLPR, o tratamento de sintomas específicos, incluindo controle de hipertensão, é recomendado juntamente com a descontinuação de Avastin®. A segurança da retomada do tratamento com Avastin® em pacientes que anteriormente tenham apresentado SLPR não é conhecida (vide item Experiência pós-comercialização).
Tromboembolismo arterial Em estudos clínicos, a incidência de tromboembolismo arterial, incluindo acidente vascular cerebral, ataque isquêmico transitório (AIT) e infarto agudo do miocárdio (IAM), foi maior em pacientes que receberam Avastin® em combinação com quimioterapia, quando comparados aos pacientes que receberam apenas quimioterapia.
Avastin® deve ser definitivamente interrompido em pacientes que desenvolverem eventos tromboembólicos arteriais.
Pacientes que recebem Avastin® mais quimioterapia, com histórico de tromboembolismo arterial ou idade acima de 65 anos, apresentam risco aumentado de desenvolvimento de eventos tromboembólicos arteriais durante o tratamento com Avastin®. Recomenda-se cautela ao tratar tais pacientes com Avastin®.
Tromboembolismo venoso (vide item Reações adversas a medicamentos)
Pacientes sob tratamento com Avastin® podem estar sob risco de desenvolver eventos tromboembólicos venosos, incluindo embolia pulmonar. Avastin® deve ser descontinuado em pacientes com embolia pulmonar com risco de morte (grau 4). Pacientes com grau ≤ 3 necessitam de monitoramento rigoroso.
Insuficiência cardíaca congestiva (vide item Reações adversas a medicamentos)
Eventos consistentes com insuficiência cardíaca congestiva (ICC) foram relatados em estudos clínicos. Os achados variaram de declínios assintomáticos na fração da ejeção ventricular esquerda a insuficiência cardíaca congestiva sintomática, exigindo tratamento ou hospitalização.
A maioria dos pacientes que desenvolveu ICC sofria de câncer de mama metastático e tinha recebido tratamento prévio com antraciclinas, além de radioterapia prévia na parede do hemitórax esquerdo ou outros fatores de risco, como doenças preexistentes do coração ou terapia concomitante cardiotóxica.
Deve-se ter cautela ao tratar, com Avastin®, pacientes com doença cardiovascular clinicamente significativa, tais como doença arterial coronariana preexistente ou insuficiência cardíaca congestiva.
Neutropenia Índices aumentados de neutropenia grave, neutropenia febril ou infecção com neutropenia grave (incluindo alguns óbitos) foram observados em pacientes tratados com alguns regimes mielotóxicos de quimioterapia associados a Avastin®, em comparação a quimioterapia sem adição de Avastin®.
Cicatrização Avastin® pode afetar de forma adversa o processo de cicatrização. O tratamento com Avastin® não deve ser iniciado durante um prazo de, no mínimo, 28 dias depois de cirurgia de grande porte ou até que a ferida cirúrgica esteja completamente cicatrizada. Em pacientes com complicações na cicatrização de feridas durante o tratamento com Avastin®, este deve ser suspenso até que a ferida esteja completamente cicatrizada. O tratamento com Avastin® deve ser suspenso antes de cirurgia eletiva (vide item Reações adversas a medicamentos).
Proteinúria (vide item Reações adversas a medicamentos)
Em estudos clínicos, a incidência de proteinúria foi maior em pacientes que receberam Avastin® em combinação com quimioterapia, quando em comparação com aqueles que receberam apenas quimioterapia. Proteinúria grau 4 (síndrome nefrótica) foi incomum em pacientes em tratamento com Avastin®. Em caso de proteinúria grau 4, o tratamento com Avastin® deve ser permanentemente descontinuado.
Reações de hipersensibilidade e à infusão Os pacientes podem ter um risco de desenvolver reações à infusão e de hipersensibilidade. Por isso, o paciente precisa ser observado cuidadosamente durante e após a administração de bevacizumabe, como esperado para qualquer infusão de um anticorpo monoclonal humanizado em uso terapêutico. Caso alguma reação ocorra, a infusão deve ser interrompida, e medidas clínicas apropriadas devem ser aplicadas. A pré-medicação sistêmica não se justifica.
Gestação e lactação Categoria de risco na gravidez: C. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Foi demonstrado que a angiogênese é muito importante para o desenvolvimento fetal. A inibição da angiogênese com a administração de Avastin® pode causar resultado adverso na gravidez.
Não houve nenhum estudo adequado e bem controlado em gestantes (vide item Dados de segurança pré-clínicos). Sabe-se que IgGs cruzam a barreira placentária e Avastin® pode inibir a angiogênese no feto. Portanto, Avastin® não deve ser usado durante a gravidez. Em mulheres com potencial para engravidar, medidas contraceptivas adequadas são recomendadas durante o tratamento com Avastin®. Com base em considerações farmacocinéticas, as medidas contraceptivas são recomendadas durante, pelo menos, seis meses depois da última dose de Avastin®.
Não se sabe se o bevacizumabe é excretado no leite humano. Como a IgG materna é excretada no leite, Avastin® pode prejudicar o crescimento e desenvolvimento do lactente. Portanto, as mulheres devem ser orientadas a interromper o aleitamento materno durante o tratamento e a não amamentar durante, pelo menos, seis meses depois da última dose de Avastin®.
Este medicamento não deve ser utilizado por mulheres durante a lactação.
Efeitos sobre a capacidade de dirigir e operar máquinas Não foram realizados estudos sobre os efeitos na capacidade de dirigir e operar máquinas. No entanto, não existe nenhuma evidência de que o tratamento com Avastin® resulte em aumento dos eventos adversos que possam levar ao comprometimento da capacidade de dirigir ou operar máquinas ou prejudicar a capacidade mental.
8. USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO
Idosos Vide item Advertências.
Crianças e adolescentes A eficácia e a segurança de Avastin® em pacientes pediátricos e adolescentes não estão estabelecidas.
Pacientes com insuficiência hepática ou renal A eficácia e a segurança de Avastin® em pacientes com insuficiência hepática ou renal não foram estudadas.
9. INTERAÇÕES MEDICAMENTOSAS Efeito de agentes antineoplásicos na farmacocinética de bevacizumabe Não foram observadas interações farmacocinéticas clinicamente relevantes de quimioterapia coadministrada a Avastin®, com base nos resultados de uma análise de farmacocinética populacional. Também não houve diferenças clinicamente relevantes nem estatisticamente significativas na depuração de bevacizumabe em pacientes que receberam Avastin® em monoterapia, quando em comparação com pacientes que receberam Avastin® em combinação com alfainterferona 2a ou outras quimioterapias (IFL, 5-FU/LV, carboplatina/paclitaxel, capecitabina, doxorrubicina ou cisplatina/gencitabina).
Efeito de bevacizumabe na farmacocinética de outros agentes antineoplásicos Resultados de estudos de interação medicamentosa demonstraram que o efeito de bevacizumabe não alterou de maneira significativa a farmacocinética de irinotecano e de seu metabólito ativo SN38 (estudo AVF3135g), da capecitabina e seus metabólitos (estudo NP18587), da oxaliplatina, determinado pela mensuração da platina livre e total (estudo NP18587), alfainterferona 2a (estudo BO17705) e da cisplatina (estudo BO17704).
A elevada variabilidade interpacientes e o tamanho limitado da amostra do estudo BO17704 não permitem uma conclusão sobre o impacto de bevacizumabe na farmacocinética da gencitabina.
Combinação de bevacizumabe e maleato de sunitinibe Em dois estudos clínicos de carcinoma de células renais, foi relatada anemia hemolítica microangiopática (AHMA) em sete dos 19 pacientes tratados com bevacizumabe (10 mg/kg, a cada duas semanas) em combinação com maleato de sunitinibe (50 mg por dia).
AHMA é uma doença hemolítica que pode se apresentar com fragmentação de glóbulos vermelhos, anemia e trombocitopenia. Adicionalmente, hipertensão (incluindo crise hipertensiva), creatinina elevada e sintomas neurológicos foram observados em alguns desses pacientes. Todos esses achados foram reversíveis com a descontinuação de bevacizumabe e maleato de sunitinibe (vide item Advertências).
Radioterapia A segurança e a eficácia de administração concomitante de radioterapia e Avastin® não foram estabelecidas.
10. REAÇÕES ADVERSAS A MEDICAMENTOS Experiência de estudos clínicos
O perfil de segurança foi estudado em pacientes com vários tipos de câncer tratados com Avastin®, predominantemente em combinação com quimioterapia. O perfil de segurança da população clínica de mais de 3.500 pacientes é apresentado neste item.
Os eventos adversos mais graves foram:
• perfurações gastrintestinais (vide item Advertências);
• hemorragia, incluindo hemorragia pulmonar/hemoptise, que é mais comum em pacientes com câncer de pulmão de não pequenas células (vide item Advertências);
• tromboembolismo arterial (vide item Advertências).
As análises dos dados de segurança clínica sugerem que a ocorrência de hipertensão e proteinúria durante o tratamento com Avastin® provavelmente dependem da dose. Os eventos adversos mais frequentemente observados em todos os estudos clínicos nos pacientes que receberam Avastin® foram hipertensão, fadiga ou astenia, diarreia e dor abdominal.
A Tabela 9 apresenta as reações adversas associadas com o uso de Avastin® em combinação com diferentes regimes de quimioterapia em múltiplas indicações. Essas reações ocorreram com pelo menos 2% de diferença, quando comparadas ao braço controle (reações graus 3 - 5 do NCI-CTC – National Cancer Institute – Common Toxicity Criteria), ou com ao menos uma diferença de 10%, quando comparada ao braço controle (reações graus 1 - 5 NCI-CTC) em ao menos um dos estudos clínicos principais. Essas reações adversas estão nas seguintes categorias: muito comum (≥ 10%) e comum (≥ 1% – <10%). A reação adversa é adicionada à categoria apropriada na tabela abaixo de acordo com a maior incidência observada em qualquer um dos principais estudos clínicos. Dentro de cada grupo de frequência, as reações adversas são apresentadas em ordem decrescente de gravidade. Algumas reações adversas são geralmente observadas com quimioterapia (por exemplo, síndrome de eritrodisestesia palmoplantar com capecitabina e neuropatia sensorial periférica com paclitaxel ou oxaliplatina). Entretanto, uma exacerbação pela terapia com Avastin® não pode ser excluída.
Tabela 9. Reações adversas comuns e muito comuns
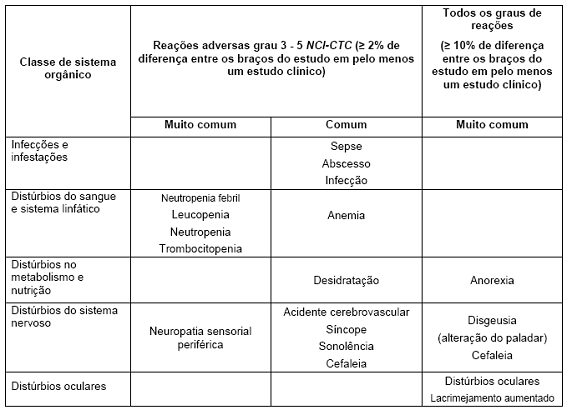
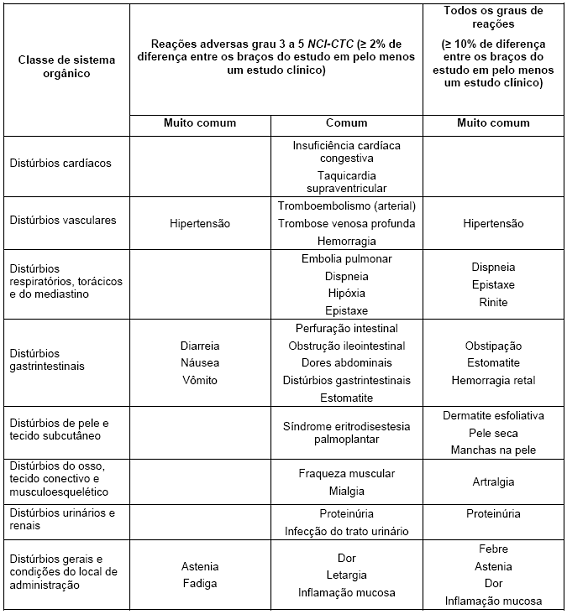
As seguintes reações adversas, relatadas usando NCI-CTC (critério comum de toxicidade) para avaliação de toxicidade, foram observadas em pacientes tratados com Avastin®:
Perfuração gastrintestinal (vide item Advertências) Avastin® tem sido associado a casos graves de perfuração gastrintestinal.
Perfurações gastrintestinais têm sido relatadas em estudos clínicos com incidência de menos de 1% em pacientes com câncer de mama metastático e de pulmão de não pequenas células não escamoso e de até 2% em pacientes com câncer colorretal metastático ou de células renais metastático.
Evolução fatal foi relatada em, aproximadamente, um terço dos casos sérios de perfuração gastrintestinal, o qual representa entre 0,2% - 1% de todos os pacientes tratados com Avastin®.
A apresentação desses eventos variou em tipo e gravidade, desde presença de ar livre observado em radiografia simples de abdome, que se resolveu sem tratamento, até perfuração intestinal com abscesso abdominal e evolução fatal. Em alguns casos, estava presente uma
inflamação intra-abdominal de base, tanto por doença ulcerosa gástrica como por necrose tumoral, diverticulite ou colite associada à quimioterapia. Uma associação causal entre processo inflamatório intra-abdominal, perfuração gastrintestinal e Avastin® não foi estabelecida.
Fístulas (vide item Advertências) Avastin® foi associado com casos graves de fístula, incluindo eventos que resultaram em óbito.
Em estudos clínicos com Avastin®, fístulas gastrintestinais foram relatadas com incidência de até 2% em pacientes com câncer colorretal metastático, mas também foram relatadas menos comumente em pacientes com outros tipos de câncer. Relatos incomuns (≥ 0,1% a < 1%) de outros tipos de fístula que envolvem áreas do corpo que não o trato gastrintestinal (broncopleural, urogenital e biliar) foram observados em várias indicações. Fístulas também foram observadas na experiência pós-comercialização.
Os eventos foram observados em diferentes períodos, durante o tratamento, variando desde uma semana até mais de um ano após o início do tratamento com Avastin®, e a maioria deles ocorreu dentro dos primeiros seis meses de terapia.
Hemorragia Em estudos clínicos realizados em todas as indicações, a incidência total de eventos hemorrágicos graus 3 - 5 NCI-CTC variou de 0,4% a 5% em pacientes tratados com Avastin®, comparada com 0 a 2,9% dos pacientes no grupo controle de quimioterapia.
Os eventos hemorrágicos observados nos estudos clínicos com Avastin® foram predominantemente hemorragia associada ao tumor (veja a seguir) e hemorragia mucocutânea mínima, como epistaxe.
– Hemorragia associada ao tumor Casos de hemorragia pulmonar/hemoptise grave ou maciça foram observados principalmente em estudos realizados em pacientes com câncer de pulmão de não pequenas células. Os possíveis fatores de risco incluem histologia escamosa, tratamento com medicamentos antirreumáticos/anti-inflamatórios, tratamento com anticoagulantes, radioterapia prévia, terapêutica com Avastin®, antecedentes de aterosclerose, localização central do tumor e cavitação do tumor antes ou durante a terapia. As únicas variáveis que mostraram estar correlacionadas de forma estatisticamente significativa com hemorragia foram a terapia com Avastin® e a histologia escamosa. Pacientes com câncer de pulmão de não pequenas células com histologia escamosa ou mista com predominância de histologia escamosa foram excluídos dos estudos subsequentes, embora pacientes com histologia do tumor desconhecida tenham sido incluídos.
Nos pacientes com câncer de pulmão de não pequenas células, excluindo histologia com predomínio escamosa, eventos de todos os graus foram observados com frequência de até 9%, quando tratados com Avastin® mais quimioterapia, em comparação com 5% dos pacientes tratados só com quimioterapia. Os eventos de graus 3 - 5 foram observados em até 2,3% dos pacientes tratados com Avastin® mais quimioterapia, em comparação com < 1% em pacientes tratados só com quimioterapia. Hemorragia pulmonar/hemoptise maior ou maciça pode ocorrer repentinamente, e em até dois terços dos casos de hemorragias pulmonares graves resultaram em evento fatal.
Hemorragias gastrintestinais, incluindo hemorragia retal e melena, foram observadas em pacientes com câncer colorretal e foram avaliadas como hemorragias associadas ao tumor.
A incidência de sangramento de sistema nervoso central em pacientes com metástases de SNC não tratadas que recebiam bevacizumabe não foi prospectivamente avaliada em estudos clínicos randomizados. Em uma análise exploratória retrospectiva, a partir de dados de 13 estudos randomizados concluídos em pacientes com tumores de vários tipos, três pacientes, de um total de 91 (3,3%) com metástases cerebrais apresentaram sangramento de SNC (todos grau 4) quando tratados com bevacizumabe, em comparação com um caso (grau 5) entre os 96 pacientes (1%) que não foram expostos ao bevacizumabe. Em dois estudos em andamento incluindo pacientes com metástases cerebrais tratadas, foi relatado um caso de sangramento de SNC grau 2 entre os 83 pacientes tratados com bevacizumabe (1,2%) no momento da análise preliminar de segurança.
Em todos os estudos clínicos de Avastin®, foi observada hemorragia mucocutânea em até 50% dos pacientes tratados com Avastin®. Foi relatada, mais comumente, epistaxe grau 1 NCI-CTC com duração menor que cinco minutos e resolvida sem intervenção clínica, não necessitando de nenhuma alteração no esquema de tratamento com Avastin®.
Dados de segurança clínica sugerem que a incidência de pequenas hemorragias mucocutâneas (por exemplo, epistaxe) possa ser dose dependente.
Também houve eventos menos comuns de hemorragia mucocutânea mínima em outros locais, como sangramento gengival ou hemorragia vaginal.
Hipertensão (vide item Advertências) Foi observada incidência aumentada de até 34% de hipertensão (todos os graus) em pacientes tratados com Avastin®, em comparação com até 14% no braço comparativo. Nos estudos clínicos de todas as indicações, a incidência global de hipertensão graus 3 e 4 NCI-CTC em pacientes que recebiam Avastin® variou de 0,4% a 17,9%. Hipertensão grau 4 (crise hipertensiva) ocorreu em até 1,0% dos pacientes tratados com Avastin® em comparação com até 0,2% dos pacientes tratados com a mesma quimioterapia isolada.
Geralmente a hipertensão foi adequadamente controlada com anti-hipertensivos orais, como inibidores da enzima conversora da angiotensina, diuréticos e bloqueadores do canal de cálcio. Raramente resultou em descontinuação do tratamento com Avastin® ou internação.
Casos muito raros de encefalopatia hipertensiva foram relatados, alguns dos quais foram fatais (vide item Advertências). O risco de hipertensão associada a Avastin® não se correlacionou com as características basais dos pacientes, doença de base ou terapia concomitante.
Tromboembolismo – Tromboembolismo arterial Uma incidência aumentada de eventos tromboembólicos arteriais foi observada em pacientes tratados com Avastin®, incluindo acidentes cerebrovasculares, infarto do miocárdio, ataques isquêmicos transitórios e outros eventos tromboembólicos arteriais.
Em estudos clínicos, a incidência global variou em até 3,8% dos pacientes tratados com Avastin® em comparação com até 1,7% nos braços de controle da quimioterapia. Evento fatal foi relatado em 0,8% de pacientes que receberam Avastin® em combinação com quimioterapia, em comparação com 0,5% dos pacientes que receberam apenas quimioterapia.
Acidentes cerebrovasculares (incluindo ataques isquêmicos transitórios) ocorreram em até 2,3% dos pacientes tratados com Avastin® em comparação com 0,5% dos pacientes no grupo de controle: infarto do miocárdio em 1,4% dos pacientes tratados com Avastin® em comparação com 0,7% dos pacientes observados no grupo controle.
No estudo clínico AVF2192g, foram incluídos pacientes com câncer colorretal metastático que não eram candidatos a tratamento com irinotecano. Nesse estudo, eventos tromboembólicos arteriais foram observados em 11% (11/100) dos pacientes tratados com Avastin® em comparação com 5,8% (6/104) no grupo controle que recebeu quimioterapia.
– Tromboembolismo venoso (vide item Advertências) Em estudos clínicos, a incidência global de eventos tromboembólicos venosos variou de 2,8% a 17,3% nos pacientes tratados com Avastin® em comparação com 3,2% a 15,6% nos braços controle que receberam quimioterapia. Eventos tromboembólicos venosos incluem trombose venosa profunda e embolismo pulmonar. Eventos tromboembólicos venosos graus 3 - 5 foram relatados em até 7,8% dos pacientes tratados com quimioterapia mais bevacizumabe em comparação com até 4,9% em pacientes que receberam apenas quimioterapia. Pacientes que apresentaram evento tromboembólico venoso podem estar sob alto risco de recorrência se receberem Avastin® em combinação com quimioterapia em comparação com quimioterapia isolada.
Insuficiência cardíaca congestiva Em estudos clínicos com Avastin®, insuficiência cardíaca congestiva (ICC) foi observada em todas as indicações avaliadas até o momento. Entretanto, ICC ocorreu, predominantemente, em pacientes com câncer de mama metastático. Em quatro estudos clínicos fase III, em pacientes com câncer de mama metastático, insuficiência cardíaca congestiva grau 3 ou maior reportada em pacientes tratados com Avastin® em combinação com quimioterapia foi de até 3,5% comparada com até 0,9% nos braços de controle. A maioria dos pacientes que desenvolveram insuficiência cardíaca congestiva durante os estudos clínicos em câncer de mama metastático apresentou melhora dos sintomas e/ou função ventricular esquerda depois de tratamento clínico adequado.
Na maioria dos estudos clínicos com Avastin®, pacientes com ICC Grau II-IV (NYHA) preexistente foram excluídos; portanto, não há informações disponíveis sobre o risco de ICC nessa população.
A exposição prévia a antraciclinas e/ou a irradiação da parede torácica podem ser possíveis fatores de risco para desenvolvimento de ICC (vide item Advertências).
Cicatrização de feridas (vide item Advertências) Como Avastin® pode ter impacto adverso sobre a cicatrização de feridas, pacientes submetidos à cirurgia de grande porte nos últimos 28 dias antes de iniciar o tratamento com Avastin® foram excluídos da participação nos estudos de fase III.
Segundo estudos clínicos realizados em câncer colorretal metastático, não houve um risco aumentado de hemorragia pós-operatória ou complicações na cicatrização de feridas observadas em pacientes que sofreram cirurgia de grande porte entre 28 - 60 dias antes do início da terapia com Avastin®. Foi observado aumento na incidência de hemorragia pósoperatória ou complicações na cicatrização de feridas ocorrendo dentro de 60 dias de cirurgia de grande porte em pacientes em tratamento com Avastin® na época da cirurgia. A incidência variou entre 10% (4/40) e 20% (3/15).
Nos estudos de câncer de mama metastático e localmente recorrente, complicações na cicatrização de feridas graus 3 - 5 foram observadas em até 1,1% das pacientes que recebiam Avastin®, em comparação com até 0,9% das pacientes dos braços de controle.
Proteinúria (vide item Advertências) Em estudos clínicos, proteinúria foi relatada na faixa de 0,7% a 38% dos pacientes que recebiam Avastin®. A proteinúria variou em intensidade, desde clinicamente assintomática, transitória, traços de proteinúria até síndrome nefrótica. Proteinúria grau 3 foi relatada em menos de 3% dos pacientes tratados por câncer colorretal e em até 7% dos pacientes tratados por câncer de células renais avançado e/ou metastático. Proteinúria grau 4 (síndrome nefrótica) foi observada em até 1,4% dos pacientes tratados. A proteinúria observada nos estudos clínicos com Avastin® não foi associada à disfunção renal e raramente exigiu interrupção permanente do tratamento com Avastin®.
Os pacientes com histórico de hipertensão podem apresentar risco aumentado para desenvolvimento de proteinúria quando tratados com Avastin®. Existem evidências que sugerem que proteinúria grau 1 pode estar relacionada à dose de Avastin®. Recomenda-se efetuar um exame de proteinúria antes do início da terapia com Avastin®. Na maioria dos estudos clínicos, níveis proteicos na urina ≥ 2 g/24 h levaram à interrupção de Avastin® até a recuperação dos níveis para < 2 g/24 h.
Reações de hipersensibilidade e à infusão Em alguns estudos clínicos, reações anafiláticas e tipo anafilactoides foram notificadas mais frequentemente em pacientes tratados com Avastin® em combinação com quimioterapia que apenas com quimioterapia. A incidência dessas reações, em alguns estudos clínicos de Avastin®, é comum (de até 5% em pacientes tratados com bevacizumabe).
Pacientes idosos Em estudos clínicos randomizados, a idade > 65 anos foi associada a risco aumentado para desenvolvimento de eventos tromboembólicos arteriais, incluindo acidentes cerebrovasculares, ataques isquêmicos transitórios e infarto do miocárdio, em comparação com os pacientes com idade ≤ 65 anos, quando tratados com Avastin® (vide itens Advertências e Reações adversas a medicamentos). Outras reações com maior freqüência em pacientes acima de 65 anos foram: leucopenia e trombocitopenia graus 3 - 4, neutropenia, diarreia, náusea, cefaleia e fadiga em todos os graus.
Não se observou aumento na incidência de outros eventos relacionados a Avastin®, incluindo perfuração gastrintestinal, complicações na cicatrização de feridas, hipertensão, proteinúria, insuficiência cardíaca congestiva e hemorragia em pacientes idosos (> 65 anos) que recebiam Avastin® em comparação com os pacientes com idade ≤ 65 anos também tratados com Avastin®.
Alterações laboratoriais Neutropenia, leucopenia e presença de proteinúria podem estar associadas ao tratamento com Avastin®.
De acordo com os estudos clínicos, as seguintes alterações laboratoriais graus 3 e 4 foram observadas com incidência aumentada (≥ 2%) nos pacientes tratados com Avastin® em comparação com aqueles nos grupos controle: hiperglicemia, hemoglobina diminuída, hipocalemia, hiponatremia, contagem diminuída de células brancas do sangue, tempo aumentado da protrombina e razão normalizada.
Experiência pós-comercialização Tabela 10. Reações adversas observadas no acompanhamento pós-comercialização
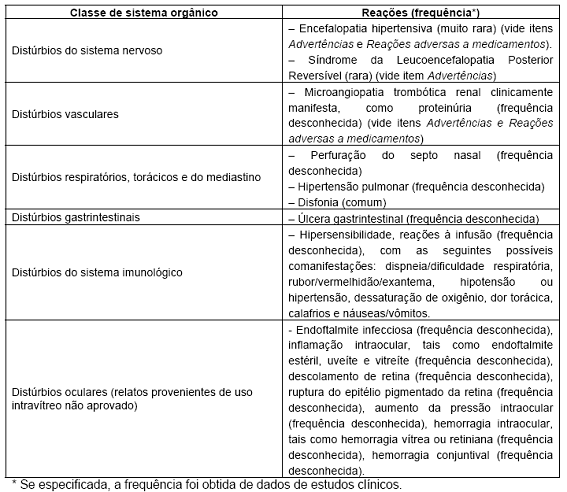
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe ao seu médico.
11. SUPERDOSE A maior dose testada no ser humano (20 mg/kg de peso corpóreo, intravenosa, a cada duas semanas) foi associada com enxaqueca intensa em vários pacientes.
12. ARMAZENAGEM Antes de aberto, Avastin® deve ser mantido em refrigerador, em temperatura de 2 a 8 ºC. O frasco deve ser mantido dentro da embalagem externa original para proteger da luz, até o momento de ser utilizado.
NÃO CONGELAR. NÃO AGITAR. Estabilidade A data de fabricação e o prazo de validade de Avastin® estão impressos na embalagem externa do produto. Não use nenhum medicamento fora do prazo de validade. Pode ser prejudicial à saúde. MS – 1.0100.0637
Farm. Resp.: Guilherme N. Ferreira – CRF-RJ nº 4288 Fabricado para F. Hoffmann-La Roche Ltd., Basileia, Suíça, por Genentech Inc, South San Francisco, CA, EUA ou Fabricado na Suíça por F. Hoffmann-La Roche Ltd., Basileia
Embalado por F. Hoffmann-La Roche Ltd., Kaiseraugst, Suíça
Importado e distribuído no Brasil por:
Produtos Roche Químicos e Farmacêuticos S.A. Est. dos Bandeirantes, 2.020 CEP 22710-104 – Rio de Janeiro – RJ
CNPJ: 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289 R www.roche.com.br USO RESTRITO A HOSPITAIS VENDA SOB PRESCRIÇÃO MÉDICA N° do lote, data de fabricação, prazo de validade: vide cartucho.
CDS 18.0
Avastin - Laboratório
ROCHE Av. Engenheiro Billings, 1729 - Jaguaré São Paulo/SP - CEP: 05321-900 Tel: 0800 7720 289 Fax: 0800 7720 292 Site: http://www.roche.com/ Estrada dos Bandeirantes, 2020 CEP: 22710-104 Rio de Janeiro - RJ
Utilizamos cookies para melhorar a sua experiência, de acordo com a nossa Política de Privacidade e, ao continuar navegando, você concorda com estas condições.





